
2024年1月10日,中国医学科学院血液病医院(中国医学科学院血液学研究所)郝牧/邱录贵团队在eBioMedicine《电子生物医学》杂志发表了题为“CRIP1 involves the pathogenesis of multiple myeloma via dual-regulation of proteasome and autophagy”的研究论文(CRIP1通过增强蛋白酶体和自噬活性介导多发性骨髓瘤对蛋白酶体抑制剂耐药)。该研究在国际上首次阐明了支架蛋白CRIP1参与自噬、蛋白酶体活性等蛋白质稳态调控的分子机制,及其在多发性骨髓瘤的增殖、耐药、疾病复发中的作用及分子机制。
多发性骨髓瘤(MM)是一种浆细胞恶性肿瘤,蛋白质稳态调控在多发性骨髓瘤发病机制中发挥重要作用。蛋白酶体抑制剂靶向抑制泛素-蛋白酶体系统(UPS)而导致细胞内蛋白质累积,破坏蛋白质稳态从而诱导MM细胞凋亡,发挥抗骨髓瘤作用。然而,MM细胞可通过自噬等蛋白质降解机制,重新恢复自身蛋白质稳态,进而介导细胞对蛋白酶抑制剂(PIs)药物产生耐药性。因此,阐明MM细胞蛋白质稳态调控的分子机制和关键信号通路将为克服MM细胞耐药,发现潜在治疗靶点提供理论依据。
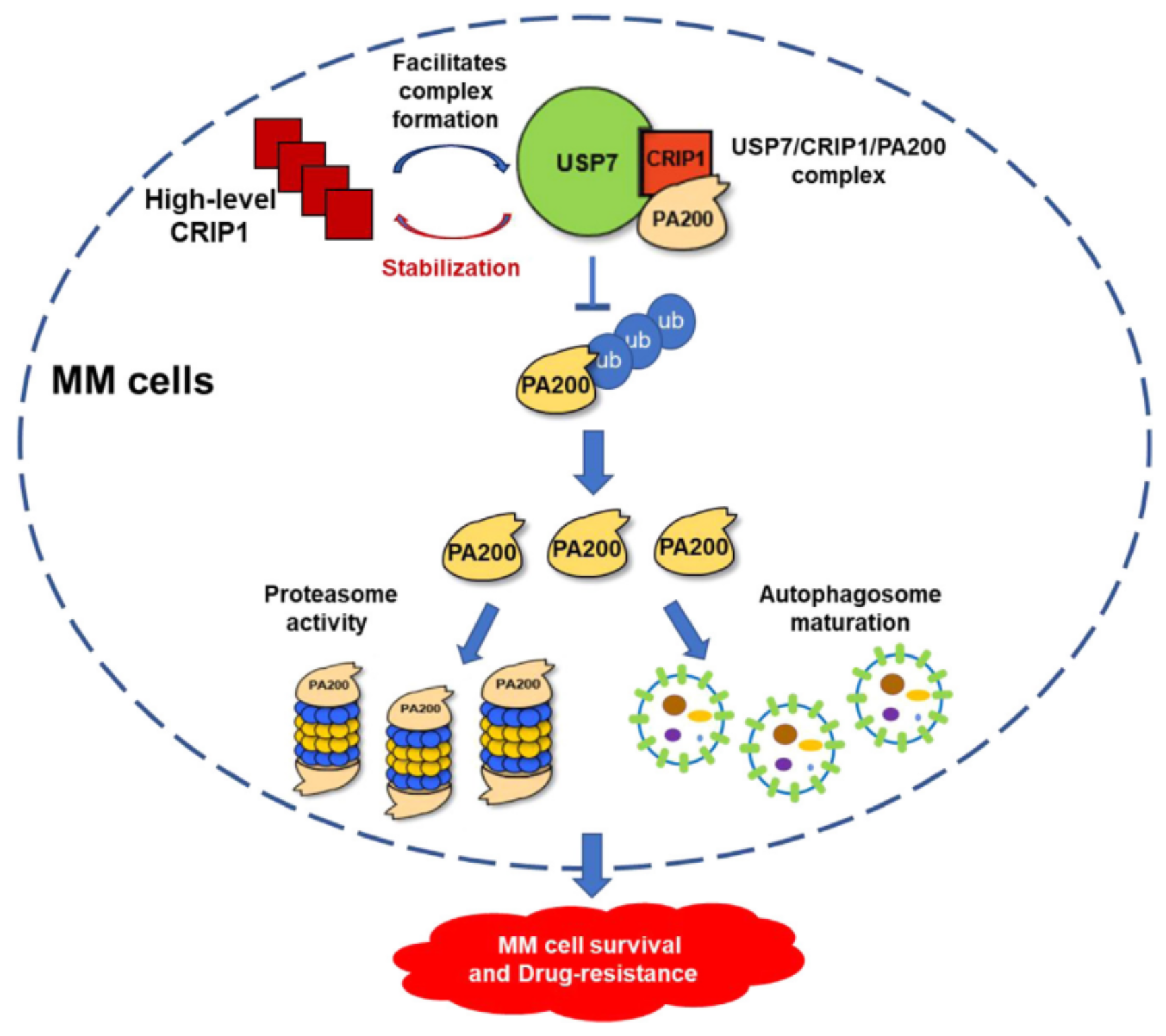
该研究发现CRIP1在MM细胞,尤其是复发/难治性MM细胞中表达升高,且MM细胞中CRIP1高表达与患者不良预后显著相关。CRIP1基因敲除显著抑制了MM细胞的生长、侵袭和迁移,增加MM细胞对PIs诱导的细胞生长阻滞的敏感性,同时基因敲除的MM细胞蛋白酶体活性和自噬活性均显著降低。通过蛋白质谱和Co-IP分析,发现CRIP1可与去泛素化酶USP7及蛋白酶体亚基PA200形成复合物,一方面稳定CRIP1在MM细胞内高水平表达,另一方面有利于USP7与PA200的相互作用,促进USP7介导的PA200去泛素化并增强其稳定性,从而促进MM细胞的存活和耐药。此外,在CRIP1过表达的MM细胞系中分别敲低USP7或PA200基因,会显著抑制MM细胞蛋白酶体活性以及自噬活性,从而增强MM细胞对PIs的敏感性。综上,该研究首次揭示支架蛋白CRIP1通过多途径调控多发性骨髓瘤细胞蛋白质稳态,促进肿瘤细胞耐药性的产生和疾病进展,为发现潜在治疗靶点提供理论依据。
该研究获得中国医学科学院医学与健康科技创新工程(2021-I2M-1-040)、国家自然科学基金(面上项目82370210、国际(地区)合作与交流项目81920108006)等的支持。血液病医院郝牧研究员、邱录贵主任医师和福建医科大学附属协和医院许贞书主任医师为共同通讯作者,血液病医院博士研究生唐培霞、于珍副主任技师为共同第一作者。
论文链接:https://authors.elsevier.com/sd/article/S2352396423005273